广州市天河区体育西路9号骏汇大厦11楼110D房 Tel: 020-38102730 E-mail: sales@kosterscience.com,technical_support@kosterscience.com
ICP备案证书号:粤ICP备16017321号-7
膜片钳(Patch-clamp)电生理学是一种被广泛运用于分析神经元内在特性及其局部关联的实验方法。 近年来,标记整个大脑神经元中特定子集转基因小鼠品系的能力为分析神经元回路与研究整个大脑的神经元多样性提供了新的方案。如今,Alessandro Galloni团队正在使用可适用于膜片钳显微镜的CoolLED pE-4000照明系统来将经tdTomato标记小鼠脑切片中的5层锥体神经元可视化,并将它们设为细胞内膜片钳记录的对象。

在全细胞膜片钳记录中,含5层活锥体神经元的脑切片。 膜片钳电极被附着于一个处于视场中央经tdTomato荧光标记神经元的体细胞(soma)。
科研人员通常通过膜片钳夹神经元、以及在电刺激突触前神经元期间测量其突触后电位的方式来研究神经元之间的连接。但对于不同大脑区域中神经元之间的远程连接,轴突常在准备脑切片时被切断。在过去的十年中,随着光遗传学的发展,研究人员发现了另一种靶向刺激突触前神经元的方法,即在其膜上建立光敏离子通道。从而实现了即使轴突被切断,它们的突触仍能够用短的光脉冲被直接激活。
自光遗传学方法被首次发现以来,学界已发现了更多具有不同动力学、离子渗透性和波长敏感性的视蛋白。 CoolLED pE-4000提供的大范围波长以及在刺激神经元时以毫秒级精度数字触发它们的能力有效为研究人员在给特定实验选择最合适的视蛋白与在其激发光谱峰值处刺激过程中提供了更大的灵活性。若两个视蛋白具有足够独立的光谱敏感性,例如对蓝光敏感的Chronos与对红光敏感的ChrimsonR,则均能够在不同的神经元群体中表达并被独立控制,从而有助于研究人员评估每个视蛋白对连接现象或单个突触后神经元活动的贡献。
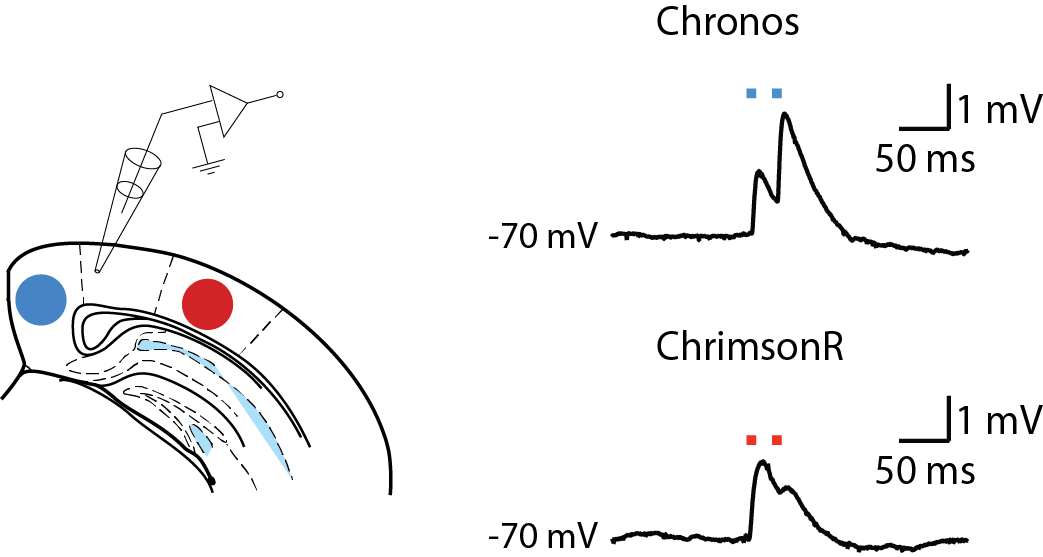
在表达对蓝光敏感的视蛋白Chronos与对红光敏感的视蛋白ChrimsonR的神经元突触前神经末梢的光刺激过程中,来自5层锥体神经元的电流钳记录。

带有CoolLED pE-4000(位于桌面下方)的膜片钳装置通过液体光导被连接于显微镜的背面,从而通过物镜照亮大脑切片。
参考用户:弗朗西斯.克里克研究所,Rancz实验室,伦敦,英国