广州市天河区体育西路9号骏汇大厦11楼110D房 Tel: 020-38102730 E-mail: sales@kosterscience.com,technical_support@kosterscience.com
ICP备案证书号:粤ICP备16017321号-7
一体化细胞免疫荧光技术介绍
免疫荧光技术(Immunofluorescence technique)又称荧光抗体技术,是标记免疫技术中发展最早的一种。它是在免疫学、生物化学和显微镜技术的基础上建立起来的一项技术。很早以来就有一些学者试图将抗体分子与一些示踪物质结合,利用抗原抗体反应进行组织或细胞内抗原物质的定位。
一.传统的免疫荧光实验步骤
(一)、实验材料
1. 细胞样品
2. 试剂、试剂盒: 多聚甲Quan;70% 甲醇;丙Tong;PBS;Triton ;BSA;DAPI 染液;DABCO;Tris;甘油
3. 仪器、耗材:玻片
(二)、实验步骤
细胞爬片免疫荧光实验步骤
第一天:
1. 在培养板中将已爬好细胞的玻片用 PBS 浸洗 3 次,每次 3 min;
2. 用 4% 的多聚甲Quan固定爬片 15 min, PBS 浸洗玻片 3 次,每次 3 min;
3. 0.5%Triton X-100( PBS 配制 ) 室温通透 20 min(细胞膜上表达的抗原省略此步骤);
4. PBS 浸洗玻片 3 次,每次 3 min,吸水纸吸干 PBS,在玻片上滴加正常山羊血清,室温封闭 30 min;
5. 吸水纸吸掉封闭液,不洗,每张玻片滴加足够量的稀释好的一抗并放入湿盒,4℃ 孵育过夜;
第二天:
6. 加荧光二抗: PBST 浸洗爬片 3 次,每次 3 min,吸水纸吸干爬片上多余液体后滴加稀释好的荧光二抗,湿盒中 20-37℃ 孵育 1 h,PBST 浸洗切片 3 次,每次 3 min;注意:从加荧光二抗起,后面所有操作步骤都尽量在较暗处进行。
7. 复染核:滴加 DAPI 避光孵育 5 min,对标本进行染核,PBST 5 min×4 次洗去多余的 DAPI;
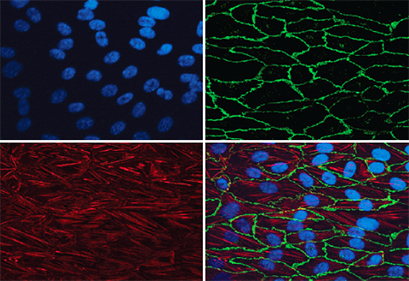
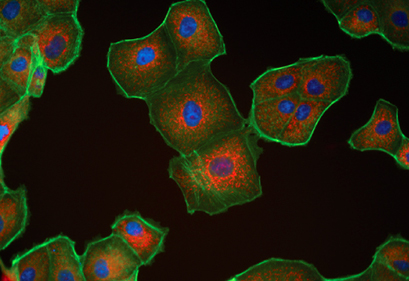
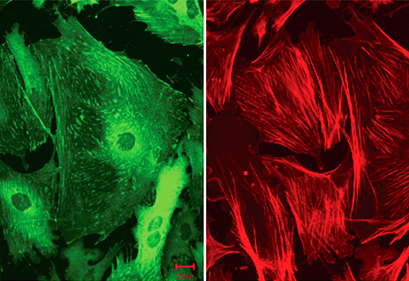
8. 用吸水纸吸干爬片上的液体,用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察采集图像
二 传统免疫荧光实验主要问题
1. 爬片效果欠佳
2. 细胞和试剂用量大,成本高
3. 染液分布不均
4. 操作繁琐,费时费力
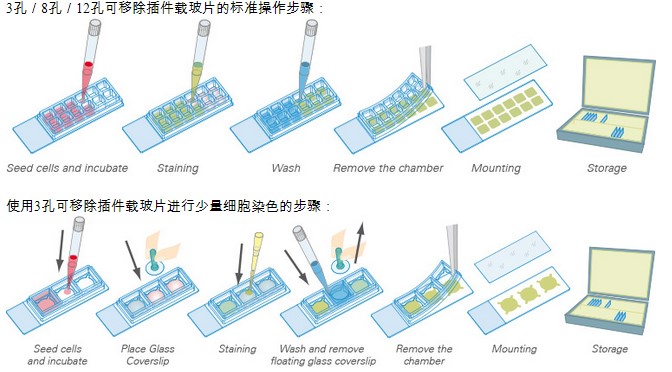
三. 一体化免疫荧光技术简介
一体化的培养室-固定-染色-成像 免疫荧光的解决方案
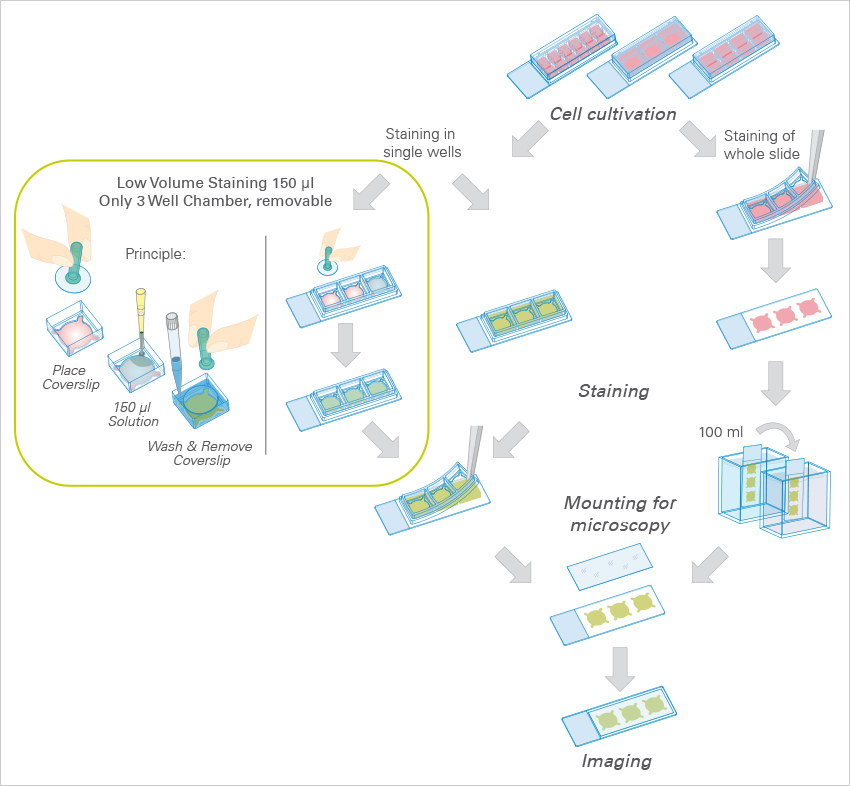
技术特点:
1.快速简便的样品制备,一体化培养室简化了免疫荧光染色方案
2.均匀细胞分布,通道载玻片几何结构可以产生均匀的细胞分布
3.经济实惠的实验方案,需要少量的细胞和试剂
4.高分辨率成像,适用于宽场荧光,共焦成像,FRAP-FRET-FLIM和高质量的相差成像(Phase Contrast)
主要工作模式:
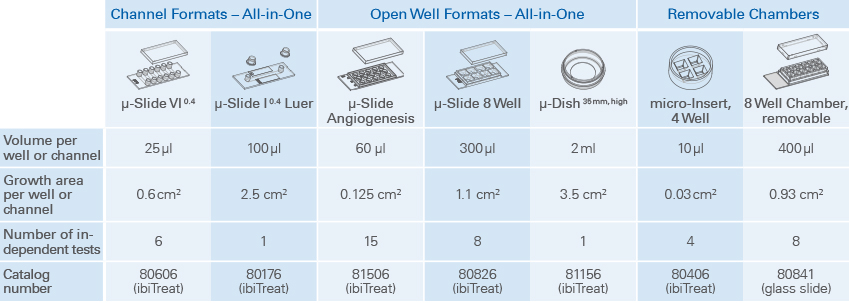
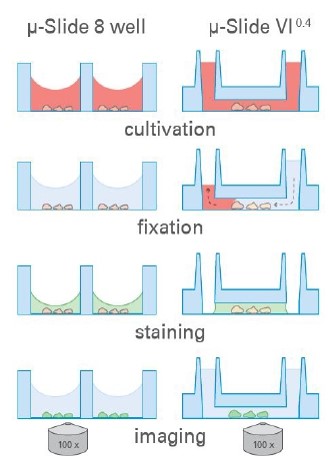
1. 通道模式:ibidi通道载玻片是使用少量试剂的理想选择。μ-Slides VI0.4是一般免疫荧光检测的理想选择,而μ-Slide I0.4Luer可在低密度培养和流动实验中进行免疫荧光染色。


2.开放腔室模式
Ibidi μ-Slide 8 孔和μ-Dish35mm 能够在全内腔中实现标准免疫荧光方案,无盖玻片。染色后,使用高分辨率显微镜通过聚合物盖玻片底部观察样品。




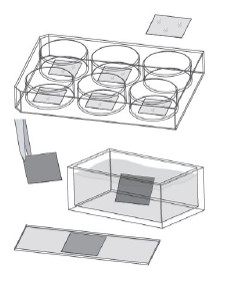
3. 可拆卸腔室载玻片模式
带有腔室的可拆卸硅垫片为个体细胞培养和孵育提供了理想的模式。ibidi micro-Insert 4 Well可以使用极低的试剂量。可拆卸3Well|8Well|12 Well Chambers是长期样品储存的理想选择。